Onkolytische Virotherapie
- Viren gegen Krebs
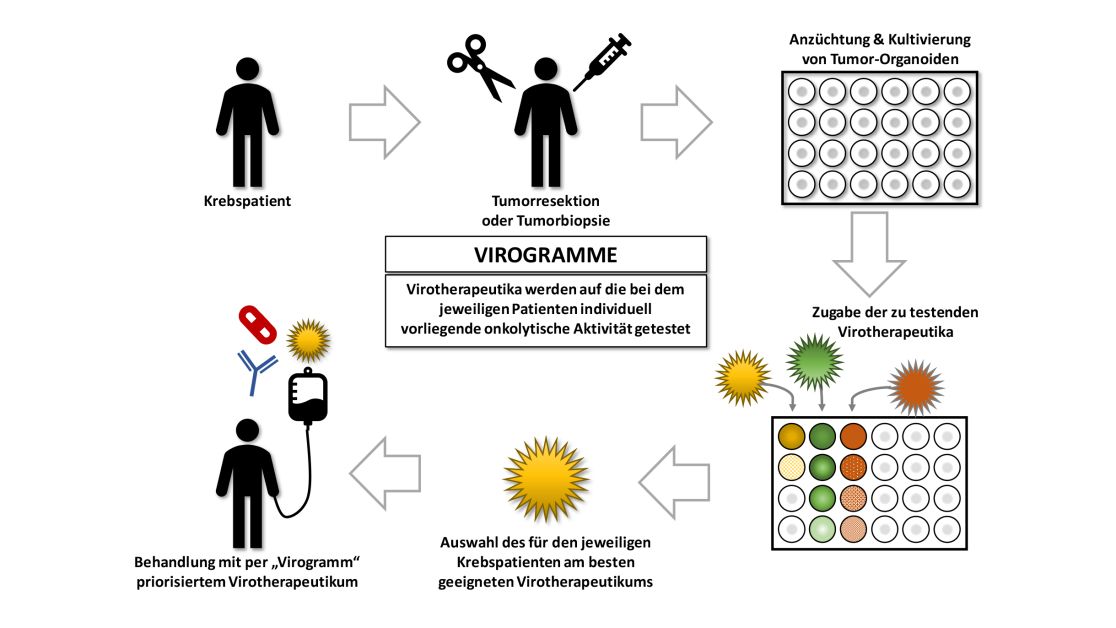
Das Virotherapie Zentrum Tübingen (VCT) fokussiert sich sowohl auf präklinische als auch auf klinische Forschungsaktivitäten im Bereich der Onkolytischen Virotherapie.
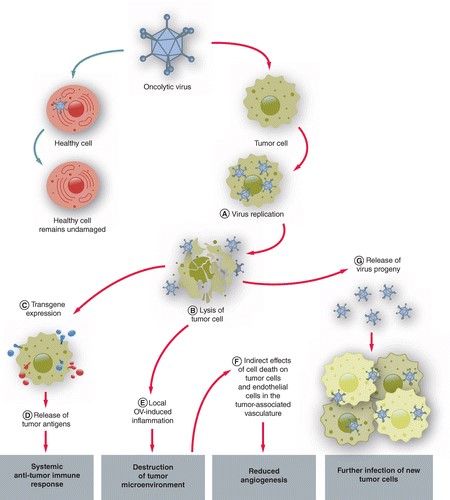
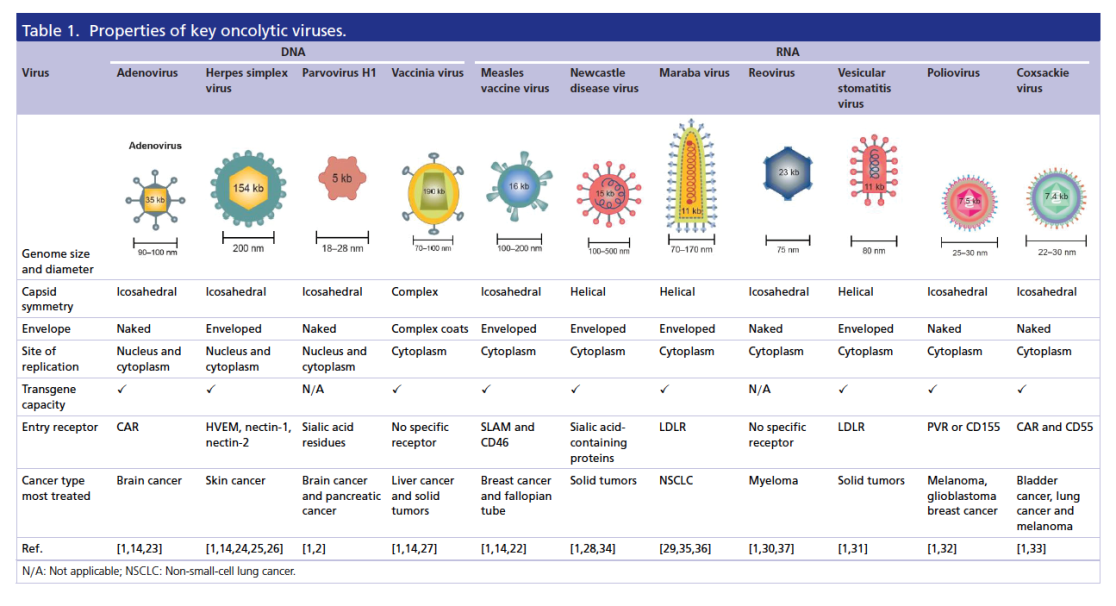
Onkolytische Viren (OV) sind in der Lage, sich spezifisch in Krebszellen zu vermehren, was zu einer direkten Zerstörung (Onkolyse) des Krebsgewebes führt; gesunde Zellen sind hingegen nicht betroffen, da es hier zu keiner relevanten Virusvermehrung kommt (siehe nachfolgende Abbildung aus: Lauer UM, Beil J. Oncolytic viruses: challenges and considerations in an evolving clinical landscape. Future Oncol. 2022 Jul 12. doi: 10.2217/fon-2022-0440).
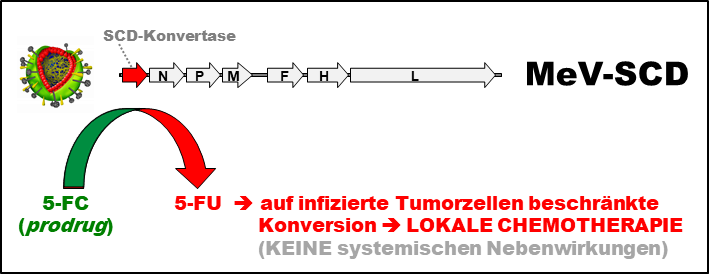
Zahlreiche onkolytische Viren üben ihre antitumorale Wirkung nicht nur durch die direkte Onkolyse der Krebszellen aus, sondern auch durch die Auslösung einer antitumoralen Immunreaktion als Folge der Tumorzell-Lyse und der damit einhergehenden Freisetzung tumorspezifischer Antigene. Zusätzlich bildet sich ein Virus-induziertes entzündliches Tumor-Mikromilieu aus, was die antitumorale Immunreaktion verstärkt. Auf diese Weise können onkolytische Viren auch bei Patienten, bei denen Standardtherapien versagen, zu einer Regression der Krebserkrankung führen. Insbesondere gentechnisch veränderte onkolytische Viren, die die Einschränkungen von Wildtyp-Viren der ersten Vektor-Generation überwinden, verfügen über ein sehr großes Potenzial für eine biologische Behandlung von Krebs.