Für das fortgeschrittene fibrolamelläre hepatozelluläre Karzinom (FL-HCC) gibt es keine systemische (auf Tumorzellen im ganzen Körper wirkende) Standardtherapie. Auch für andere Tumorerkrankungen mit Nachweis einer DNAJB1-PRKACA Genfusion, wie z. B. bestimmte bösartige Neubildungen von Bauchspeicheldrüse oder Gallengängen, sind die medizinischen Behandlungsmöglichkeiten eingeschränkt. Die Studie untersucht den therapeutischen Krebs-Peptidimpfstoff Fusion-VAC-XS15 in Kombination mit einer Immuncheckpoint-Blockade durch Atezolizumab (Tecentriq®) als Therapie bei fortgeschrittenem fibrolamellären hepatozellulären Karzinom oder einer anderen Tumorerkrankung mit Nachweis einer DNAJB1-PRKACA Genfusion.
Kombinierte Immuntherapie
mit Peptidimpfung und Immun-Checkpoint-Blockade bei Tumorerkrankungen mit DNAJB1-PRKACA Genfusionen
Übersicht
Warum gibt es bei FL-HCC keine systemische Standardtherapie?
FL-HCC ist eine seltene Tumorerkrankung, die typischerweise Menschen ohne zugrundeliegende Lebererkrankung in der Vorgeschichte betrifft. In den letzten Jahren wurde ein zunehmendes Auftreten dieser Tumoren beobachtet. Das 5-Jahres-Überleben von Patienten mit einem FL-HCC liegt bislang bei nur 45%. Das ist vor allem darin begründet, dass die Entfernung des Tumors durch eine Operation bislang die einzige Behandlungsmöglichkeit ist, mit der eine Heilung erzielt werden kann. Eine Operation kann jedoch nur dann sinnvoll durchgeführt werden, wenn der Krebs vor dem Auftreten von Metastasen (Streuung der Tumorzellen in andere Organe) diagnostiziert wird. Sind bereits Tochtergeschwülste (Metastasen) aufgetreten oder ist es zu einem Rückfall der Erkrankung in Form von Metastasen nach primärer Operation gekommen, ist die einzige Möglichkeit eine gerichtete so genannte systemische Therapie, die alle Tumorzellen im Körper erreicht, z. B. in Form einer Chemotherapie. Das FL-HCC spricht nach aktuellem Kenntnisstand allerdings nur selten auf Chemotherapien oder andere systemische Therapien längerfristig an, sodass es zum heutigen Zeitpunkt keine Standardbehandlung des fortgeschrittenen FL-HCC gibt. Dies macht die Entwicklung neuer Behandlungsoptionen dringend erforderlich.
Was ist eine therapeutische Krebsimpfung?
Seit vielen Jahren dienen Impfungen dazu, ansteckende Erkrankungen wie Masern, Mumps und Grippe zu verhindern. Prinzip dieser Impfungen ist, dass Teile von Krankheitserregern (auch Antigene genannt) den Patienten verabreicht werden. Dadurch wird das Immunsystem aktiviert und bei einem späteren Kontakt mit diesen Krankheitserregern werden diese erkannt und bekämpft. Heute nimmt man an, dass eine neue Art von Impfungen auch für die Behandlung von Tumoren genutzt werden kann. Im Gegensatz zu Infektionskrankheiten, bei denen die Impfung vorbeugend erfolgt, werden diese Krebs- oder Tumorimpfungen bei Betroffenen eingesetzt, die bereits an Krebs erkrankt sind. Man spricht daher in diesem Fall von therapeutischen Krebsimpfungen. Ein attraktives Ziel für eine solche therapeutische Krebsimpfung bei fortgeschrittenen Tumorerkrankungen stellt ein bestimmtes genetisches Erkennungsmerkmal des Tumors dar. Diese Veränderung kann als Zielstruktur genutzt werden, um das Immunsystem mit einer therapeutischen Krebsimpfung gegen den Tumor zu richten.
Was ist ein Fusionstranskript?
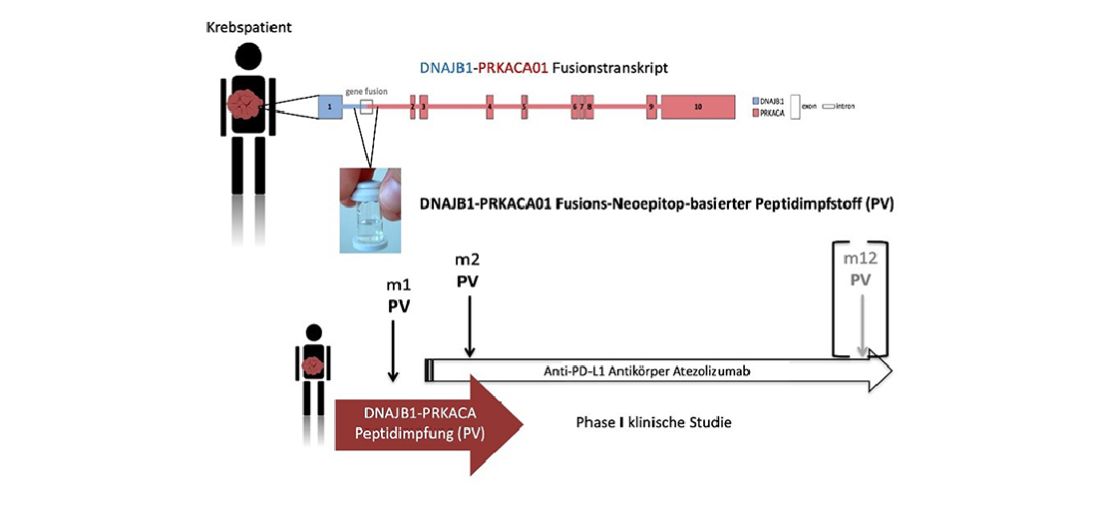
In aktuellen Untersuchungen von Tumorgewebe der Patientinnen und Patienten mit fibrolamellärem hepatozellulären Karzinom konnte die sogenannte DNAJB1-PRKACA-Genfusion als genetisches Erkennungsmerkmal des Tumors identifiziert werden. Ein Fusionstranskript ist ein „kombiniertes“ Eiweiß, das basierend auf dem Zusammenschluss von zwei verschiedenen Genen gebildet wird und maßgeblich für die Tumorentstehung verantwortlich ist. Die DNAJB1-PRKACA-Genfusion ist bei FL-HCC als Auslöser der Tumorentstehung vorhanden, es gibt aber auch Einzelfälle von anderen Tumorerkrankungen, z. B. der Bauchspeicheldrüse oder der Gallengänge, bei denen das DNAJB1-PRKACA Fusionstranskript nachgewiesen wird.
Der Impfstoff Fusion-VAC-XS15
Der in dieser Studie verabreichte therapeutische Krebsimpfstoff Fusion-VAC-XS15 enthält ein Peptid (Eiweiß), das von dieser DNAJB1-PRKACA-Genfusion abgeleitet worden ist. Damit die therapeutische Krebsimpfung eine Reaktion des Immunsystems gegen den Tumor bewirken kann, muss neben dem Impfpeptid ein Immunstimulator, ein sogenanntes Adjuvanz, eingesetzt werden. Als Adjuvanz wird in dieser Studie die Substanz XS15 eingesetzt, die gemeinsam mit dem Impfpeptid und dem Emulgator Montanide unter die Haut gespritzt wird. XS15 dient dazu die Immunzellen an der Impfstelle zu aktivieren und so eine starke Antwort des Immunsystems zu ermöglichen. Die Ergebnisse zur Anwendung von XS15 am Menschen aus ersten Studien sind hinsichtlich der Verträglichkeit und Wirksamkeit des Immunstimulators vielversprechend. Vorläufige Ergebnisse, von bisher 4 laufenden Studien mit Peptidimpfstoffen, die XS15 enthalten, zeigen, dass durch die Impfung eine gute und starke Reaktion des Immunsystems, vor allem der sogenannten T-Zellen gegen die jeweiligen verwendeten Impfpeptide, angeregt werden konnte.
Was ist eine Immuncheckpoint-Inhibitor-Therapie?
Ein Checkpointinhibitor ist ein Antikörper, der Immunzellen (die sog. T-Zellen) aktiviert, indem er das Zusammenspiel des PD1-Rezeptors (PD1 = programmed cell death protein 1), eine Markierungsstelle auf den Immunzellen, und des PD1-Liganden (PD-L1 = programmed cell death 1 ligand 1) blockiert, deshalb werden sie auch Checkpointblocker genannt. Manche Tumoren produzieren das Protein PD-L1, dass durch das Binden an den PD1-Rezeptor, die körpereigenen Immunzellen daran hindert, den Tumor zu erkennen und effektiv zu bekämpfen. Durch die Blockade des PD-1 Rezeptors oder von PD-L1 können Immunzellen nicht mehr in Ihrer Arbeit behindert werden. Der Krebs ist so für das Immunsystem sichtbarer und kann durch den eigenen Körper besser bekämpft werden. Die Wirkung eines Checkpoint-Inhibitors erfolgt allerdings generell und unspezifisch, d.h. nicht zielgerichtet gegen eine spezifische Tumorart. Insbesondere die durch therapeutische Impfung ausgelöste spezifische Reaktion des Immunsystems gegen den Tumor soll durch den Checkpointinhibitor verstärkt und verbessert werden. Der in dieser Studie eingesetzte Checkpointinhibitor Atezolizumab (Tecentriq®), ein gegen PD-L1 gerichteter Antikörper, wird von der Roche Pharma AG zur Verfügung gestellt.
Ziel der Studie
Patentinnen und Patienten gesucht!
Wer kann an der Studie teilnehmen?
- Patienten mit lokal fortgeschrittenen oder metastasiertem FL-HCC
- Patienten mit einer anderen bösartigen lokal fortgeschrittenen oder metastasiertem Tumorerkrankung mit Nachweis des DNAJB1-PRKACA Fusionstranskripts für die keine etablierte Standardtherapie möglich ist
Interessiert an einer Studienteilnahme?
Dann melden Sie sich bitte per E-Mail bei der KKE Translationale Immunologie
E-Mail-Adresse: kketi@med.uni-tuebingen.de
Wie ist der Ablauf der Studie?
Vorauswahl
Zweck der Vorauswahl-Phase ist es festzustellen, ob Sie an dieser Studie teilnehmen können. Der Aufenthalt für die Voruntersuchungen dauern für gewöhnlich etwa 3-4 Stunden. Erst wenn die Ergebnisse aller Tests vorliegen, kann Ihnen Ihr Prüfarzt sagen, ob Sie für die Studie in Frage kommen oder nicht.
Impfungen
Sie erhalten im Rahmen der Studie mindestens zwei Impfungen mit dem Fusion-VAC-XS15-Peptidimpfstoff. Die Impfungen erfolgen subkutan, das bedeutet der Impfstoff wird mit einer Nadel unter die Haut des Bauches gespritzt. Um den Einfluss der Impfungen auf Ihr Immunsystem zu untersuchen, werden Ihnen regelmäßig Blutproben abgenommen. Es gibt die Möglichkeit einer erneuten Impfung nach 11 Monaten, sofern Ihre Immunantwort zu dem Zeitpunkt bereits messbar nachgelassen hat.
Therapie
Atezolizumab erhalten Sie als intravenöse Infusion alle vier Wochen. Die Behandlung wird über zwölf Monate durchgeführt, außer es kommt zu einem Fortschreiten der Erkrankung oder zu anderen Gründen, die einen Abbruch der Studie zur Folge haben.
Nachsorge
Nach der letzten Atezolizumab-Infusion ist es notwendig, dass Sie viermal zu einer Nachuntersuchung ins Krankenhaus kommen. Die letzte Kontrolle und Ende der Studie ist sechs Monate nach der letzten Behandlung.
Studienleitung

Prof. Dr. Juliane Walz
Medizinische Direktorin KKE Translationale Immunologie, Medizinische Klinik
Universitätsklinikum Tübingen
Wissenschaftliche Leitung der Studie / Sponsors Delegate
Personenprofil: Mehr zur Person

Prof. Dr. Helmut Salih
Ärztlicher Direktor KKE Translationale Immunologie, Medizinische Klinik Universitätsklinikum Tübingen
Prüfleiter (Principal Investigator) der Studie
Personenprofil: Mehr zur Person

Stellv. Ärztlicher Direktor Innere Medizin I, Stellv. Prüfleiter
Publikationen: Publikationen