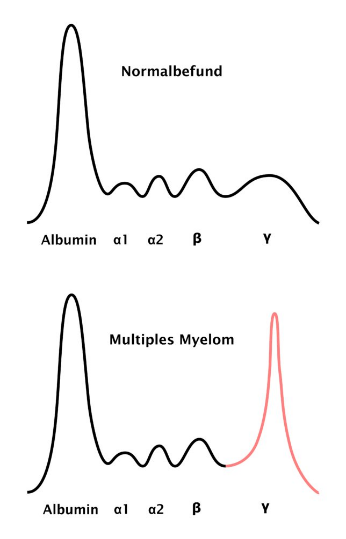
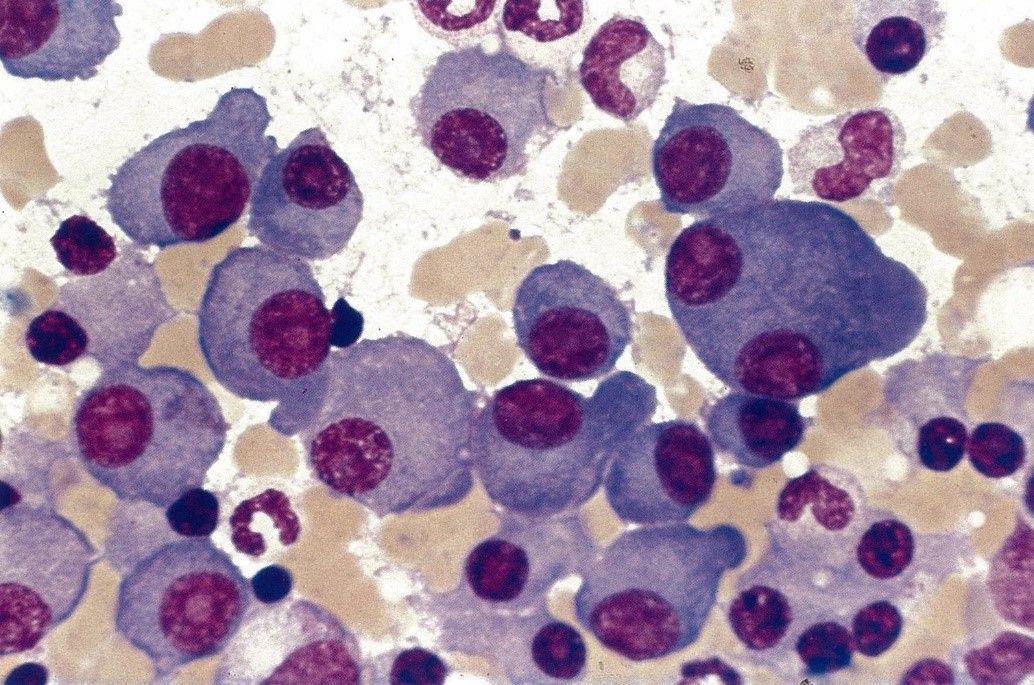
Multiples Myelom
Das Multiple Myelom ist die zweithäufigste bösartige hämatologische Erkrankung. Die Krankheit kann sich durch Knochenschmerzen und Knochenbrüche, aber auch durch eine Blutarmut (Anämie) oder durch eine Verschlechterung der Nierenfunktion ausdrücken. In den letzten Jahren haben sich die Möglichkeiten in Diagnostik und Therapie der Myelomerkrankung nachhaltig verbessert. Bei keiner hämatologischen Erkrankung wurden in den letzten 10 Jahren so große Fortschritte erzielt. Es wurden neue Therapiestandards gesetzt und neue Medikamente verfügbar gemacht. An unserem Zentrum sind neue bildgebende Verfahren und Verfahren zur extrakorporalen Therapie (sog. Leichtkettendialyse) entwickelt worden, die zur optimierten Diagnostik und Therapie der Erkrankung beitragen.