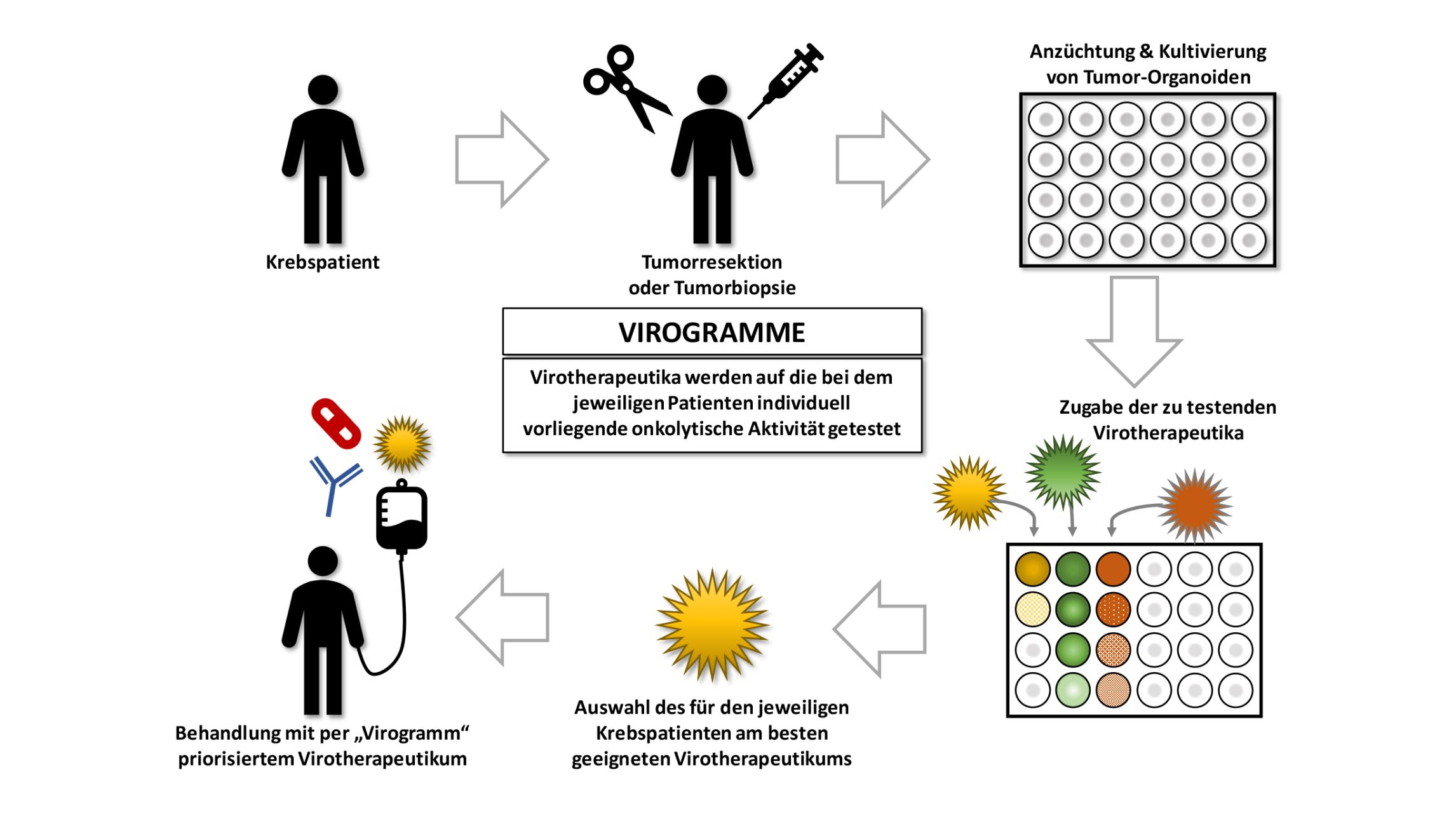
Oncolytic virotherapy - viruses against cancer
The Virotherapy Center Tübingen (VCT) focuses on both preclinical and clinical research activities in the field of oncolytic virotherapy.
Oncolytic viruses (OV) are able to multiply specifically in cancer cells, which leads to direct destruction (oncolysis) of the cancer tissue; healthy cells, on the other hand, are not affected, as no relevant virus multiplication occurs here (see figure from: Lauer UM, Beil J. Oncolytic viruses: challenges and considerations in an evolving clinical landscape. Future Oncol. 2022 Jul 12. doi: 10.2217/fon-2022-0440).