Forschungsgruppe Physiologie und Pathophysiologie roter Blutkörperchen (Erythrozyten)
Eine Referenzperson, die 20-30 Jahre alt, 70 kg schwer und 170 cm groß ist, besitzt insgesamt ~30 Billionen Zellen. Dabei machen Erythrozyten (human red blood cells, hRBC) mit ~25 Billionen ca. 84% der Gesamtzellen aus. Die Abbildung 1 veranschaulicht die prozentuale Verteilung der Anzahl menschlicher Zellen nach Zelltyp [1].
Hinzu kommen ~38 Billionen Bakterien, die bei einer Referenzperson über den ganzen Körper und v.a. im Darm verteilt sind. Diese Bakterien als essentieller Bestandteil unseres Mikrobioms machen ~0,3 % des gesamten Körpergewichts aus (für weitere Details siehe [1]). Zirkulierende hRBCs haben eine Lebensdauer von 120 Tagen [2]. Täglich werden also ca. 1% (~250 Milliarden) der zirkulierenden hRBCs abgebaut und gleichzeitig im Knochenmark durch Erythropoese (Neubildung der Erythrozyten) ersetzt, das entspricht folglich zwei Millionen hRBCs pro Sekunde.

Verkürzt kann man die induzierte Bildung von hRBCs durch Erythropoese wie folgt zusammenfassen:
Hypoxie → Leber & v. a. Niere → Hif-2a/Hif-b-Hochregulation → EPO Produktion → Knochenmark → verstärkte Erythropoese.
Eine Dysregulation der Erythropoese führt zur Polyzythämie bzw. Anämie. Anämien können grob in Eisenmangelanämien (iron-deficiency anemia/IDA) und Entzündungs-bedingte Anämie (anemia of inflammation bzw. anemia of chronic disease/ACD)) unterteilt werden. IDA kann normalerweise durch Zufuhr von Eisen-haltiger Nahrung behoben werden.
Bei ACD hingegen ist das körpereigene gespeicherte Eisen reichlich vorhanden, jedoch nicht für die Erythropoese verfügbar. Das Spektrum von ACD umfasst viele Krankheiten wie: rheumatoide Arthritis, Lupus Erythematodes, Parodontal-Erkrankungen, diverse low-grade Infektionen, Malaria, Krebs, Nierenversagen und Herzerkrankungen. Die Hauptursache für die gestörte Eisenfreisetzung ist das von Hepatozyten freigesetzte Protein Hepcidin, das an Ferroportin bindet und zu dessen Internalisierung und Proteolyse führt, wodurch die Fähigkeit der Speicherzellen, Eisen zu exportieren, effektiv verringert wird. Die Behandlung von ACD umfasst die gleichzeitige Verabreichung von EPO und intravenöses Eisen.
Erythrozyten sind kern- und organellenfreie Zellen, die im Prinzip nur aus einer Zellmembran und dem darin befindlichen Zytoskelett inkl. der zytosolischen Proteine und niedermolekularen Substanzen bestehen. Die Hauptbestandteile aller biologischen Membranen sind Proteine, Lipide und Kohlenhydrate in unterschiedlichen Anteilen. Letztere machen <10% der Masse der meisten Membranen aus und sind in der Regel entweder an die Lipid- oder die Proteinkomponenten gebunden.
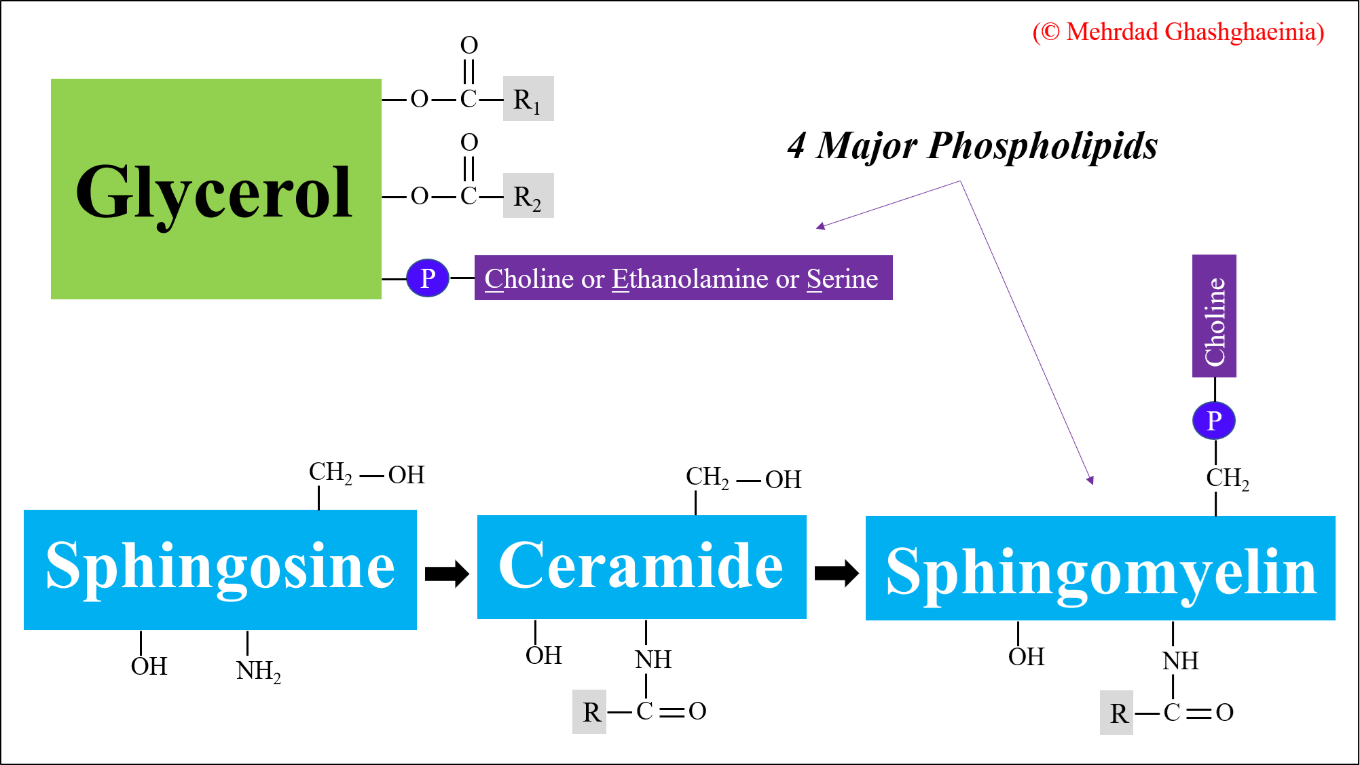
Die wichtigsten Membranlipide sind Phospholipide, Cholesterin und Glykolipide. Glykolipide fungieren als Zellantigene und bestimmen zusammen mit Glykoproteinen die Oberflächenmerkmale einer Zelle, die sie von anderen Zellen unterscheiden. Die menschliche Erythrozytenmembran wiederum besteht aus 40% Lipiden (Phospholipide, Sphingolipide, Triglyzeride und Cholesterol), 52% Proteinen und 8% Kohlenhydraten. In wässriger Umgebung assoziieren Phospholipide spontan zu einer Doppelschicht, wobei ihre polaren, hydrophilen Kopfgruppen dem wässrigen Medium zugewandt sind. Solche Doppelschichten sind die strukturelle Grundlage aller Zellmembranen. Die Funktionalität einer Zelle ist direkt mit der asymmetrischen Verteilung der Phospholipide innerhalb der doppelschichtigen Zellmembran assoziiert, wobei die Cholin-haltigen Phospholipide (Phosphatidylcholin (PC) und Sphingomyelin (SM)) vorwiegend auf der äußeren Schicht und Phosphatidylethanolamin (PE), Phosphatidylserin (PS) sowie Phosphtatidylinositol (PI) zum größten Teil in der inneren Schicht der Membran lokalisiert sind. Unter physiologischen Bedingungen und bei einer Temperatur von 37 °C befinden sich die Phospholipide in einem flüssig-kristallinen Zustand (liquid-crystal state), in dem die Membranproteine sich nach den Seiten hin bewegen können. Die vier Hauptphospholipide (PC, PE, PS und SM) sind in Abbildung 2 dargestellt.
Cholesterin ist ein weiteres wichtiges Lipid, das in großer Konzentration in der Plasmamembran von Säugetierzellen sowie hRBCs vorkommt. Unter physiologischen Bedingungen liegt das molare Verhältnis von Cholesterin zu Phospholipid bei 0,82 [3]. Die Rolle des Cholesterins ist aufgrund mangelnden Wissens nach wie vor höchst umstritten. Zum einen ist eine ausbalancierte Menge an Cholesterin notwendig für das Wachstum und Überleben der Zellen. Überschüssige Mengen dieses wasserunlöslichen Stoffes lagern sich allerdings in oder an arteriellen Gefäßen und Gefäßzellen ab und verstärken dadurch die Entwicklung von Atherosklerose. Daher stehen die Säugetierzellen vor dem Dilemma entweder a) ausreichend Cholesterin für das Wachstum und die Erneuerung der Membran bereitzustellen oder b) eine andauernde übermäßige Synthese und Akkumulation dieses Lipids zu vermeiden. Zusammenfassend kann man sagen, dass ein direkter Zusammenhang zwischen Cholesteringehalt, struktureller Integrität und Überlebensgrad in hRBCs besteht. Cholesterindepletion führt Spezies-übergreifend zur einer erhöhten Externalisierung von PS (loss of membrane PS asymmetry) und somit zur Phagozytose und Eliminierung der Erythrozyten [4,5]. Die Abbildung 3 illustriert sowohl die PS-Externalisierung als Zeichen des Erythrozytentods (im folgenden als Eryptose bezeichnet) als auch die damit assoziierten Veränderungen der intrazellulären Ionenzusammensetzung.

Das Phänomen der Eryptose wird i.d.R. begleitet von einem Ca2+-Einstrom in die Erythrozyten bei einem gleichzeitigen Austritt von Wasser-, Kalium (K+)- und Chlorid (Cl-)-Ionen aus den Zellen. Man spricht in diesem Zusammenhang auch von einer Eryptose-induziertern Erythrozytenschrumpfung. Allerdings zeigt sich unter bestimmten Umständen, wie z. B. im Fall der vom Medikament Trifluoperazin (TFP) induzierten Eryptose, konzentrationsabhängig sowohl eine Schrumpfung als auch ein Anschwellen der hRBCs bei PS-positiven, also eryptotischen Zellen (siehe Abbildung 4 und [6]).

In intakten hRBCs trägt der hohe Cholesteringehalt zur Stabilität und Funktionstüchtigkeit der Zellmembran bei; dadurch wird sowohl die hypotone als auch die Druck-induzierte Hämolyse weitestgehend unterbunden [7] (Abbildung 5). Auch wird eine inhibitorische Wirkung auf hydrolytische Enzyme wie z.B. die sekretorische Phospholipase A2 (sPLA2) ausgeübt [8]. Ein wichtiger früher Schritt bei der Atherosklerose ist die Bindung von Apolipoprotein B-100 (apoB-100)-haltigen Lipoproteinen (VLDL, IDL und LDL) an die Proteoglykan-Komponente der extrazellulären Matrix der arteriellen Intima. Die nicht-oxidativen Modifikationen von Proteoglykan-gebundenen-apoB-100-haltigen Lipoproteinen (LPs) durch sPLA2, das heißt die Hydrolyse der Phosphatidylcholin (PC) Moleküle in diesen LPs ist ein Schlüsselfaktor bei der Entstehung der Atherosklerose.

Der essentielle Bedarf an Cholesterin in Säugetierzellen lässt sich zum Teil auf seine wichtige Rolle in den Membranen zurückführen. Cholesterin geht hierbei Interaktionen mit Membranproteinen ein, die durch seine Bindung an spezifischen Stellen dieser Membranproteine entstehen. Eine Reihe von Ionenpumpen der Plasmamembran werden dadurch positiv von Cholesterin reguliert, darunter die 3Na+-2K+-ATPase, die für transmembranäre Ionengradienten verantwortlich ist. Von der Aktivität dieser Ionenpumpen hängen etliche zelluläre Funktionen ab [9,10]. Auf der anderen Seite verlieren viele Membranenzyme jedoch bei sehr hohem Membrancholesteringehalt ihre Aktivität. Dies ist aber auf eine separate Eigenschaft von Cholesterin zurückzuführen; sehr hoher Cholesteringehalt verstärkt die Bewegungsordnung der Membranlipide, wodurch die Transmembranpermeabilität reduziert und die Konformationsflexibilität des Transmembranproteins gehemmt werden [11].
Unter physiologischen Bedingungen enthält ein einziger Eythrozyt ~190 Millionen (1,9 x 108) Phospholipide [12] und ~160 Millionen (1,6 x 108) Cholesterin-Moleküle [3]. Angesichts dieser Tatsachen sollte die Diskussion über erhöhte „freie“ Cholesterinwerte nicht zu einseitig geführt werden. hRBCs spielen auch eine wichtige Rolle bei Immun- und Abwehrmechanismen. So vermitteln zum Beispiel Komplement 3b und Komplementrezeptor 1 die Anheftung von Erythrozyten an sich im Blutplasma befindenden Bakterien. Dies führt zur Phagozytose von Erythrozyten-gebundenen Bakterien in der Leber und der Milz, wobei die Rückführung der nach wie vor intakten Erythrozyten in den Blutkreislauf in diesem Mechanismus eingeschlossen ist. hRBCs fungieren weiterhin als Behältnis für Sphingosin-1-Phosphat (S1P). Sie geben dieses Molekül bei Bedarf über einen fein regulierten Mechanismus an das Blutplasma ab. S1P reguliert die Lymphozyten-zirkulation, erhält die Integrität der Endothelzellbarriere aufrecht und übt eine schützende Wirkung auf die Niere aus.
Darüber hinaus wird die vaskuläre Entwicklung der Niere durch das Zusammenspiel von S1P, hRBCs und vaskulärem Endothel positiv reguliert. hRBCs sind mittels eines spezifischen Chemokinrezeptors zudem in der Lage, eine Reihe der entzündlichen Chemokine, einschließlich IL-8, zu binden und so überschießende Entzündungsreaktionen einzudämmen. Interessanterweise entwickeln 20% der mit SARS-CoV-2 infizierten Patienten ein akutes Atemnotsyndrom, das mit einer erheblichen Freisetzung von Chemokinen und pro-inflammatorischen Zytokinen (zum Beispiel IL-8) einhergeht und schlußendlich in einem Multiorganversagen gipfelt. Diese Daten zeigen, dass hRBCs nicht nur respiratorische, sondern auch anti-inflammatorische und immunmodulierende Funktionen inne haben können. Daher ist die Anwendung von Substanzen, welche die Vitalität der Erythrozyten verbessern und gleichzeitig Pathogene beziehungsweise Pathogen-infizierte Wirtszellen eliminieren, eine gute Wahl und möglicherweise von großer Bedeutung für die Behandlung infektiöser Erkrankungen wie COVID-19 (für weitere Details siehe [13] sowie Abbildung 6).

