Die AG „Biokompatibilität und Oberflächenfunktionalisierung“ befasst sich schwerpunktmäßig mit dem Nachweis der Biokompatibilität (dentaler) Biomaterialien durch eine Reihe an biologischer Testverfahren. Hierbei kommen In-vitro- sowie In-vivo-Modelle zur Untersuchung der Zytotoxizität, der Immunogenität und der Hämokompatibilität sowie zur Minimierung der bakteriellen Biofilmbildung zum Einsatz. Gleichzeitig liegt ein wesentlicher Schwerpunkt auf der Erforschung und Herstellung von neuartigen passiven und aktiven Beschichtungen, um die Biokompatibilität dieser Implantate zu verbessern. Zudem ist ein primäres Ziel die Entwicklung einer innovativen Therapiestrategie zur Beschleunigung der Wundheilung. Gemeinsam mit der AG „Biomaterialien und Implantate am biologischen Interface“ wird die antibakterielle Wirkung von Totarol, einer natürlichen Substanz, die aus der Steineibe Podocarpus totara extrahiert wurde, für biomedizinische Anwendungen untersucht. Neben Antibiotika, deren Wirkung inzwischen durch antibiotikaresistente Keime eingeschränkt ist, können solche natürlichen antibakteriellen Wirkstoffe als Prophylaxe gegen Wundinfektionen eingesetzt werden. Totarol hat hier bereits eine antibakterielle Aktivität gegen verschiedene Bakterien gezeigt, einschließlich Staphylococcus aureus und Methicillin-resistenten Staphylococcus aureus (MRSA).
AG Krajewski „Biokompatibilität und Oberflächenfunktionalisierung“
Kontakt
Leitung:
Prof. Dr. Stefanie Krajewski
E-Mail-Adresse: stefanie.krajewski@med.uni-tuebingen.de
|
Dr. Antonia Theurer |
07071-29-85781 07071-29-3982 |
E-Mail-Adresse: antonia.theurer@med.uni-tuebingen.de
Forschungsschwerpunkte:
Forschungsschwerpunkte
Analyse der hämokompatiblen Eigenschaften von blutkontaktierenden Implantaten und Dentalimplantaten
Neben blutkontaktierenden Implantaten kommt es auch bei Dentalimplantaten während der Implantation zum Blutkontakt mit der Biomaterialoberfläche, wodurch es zur initialen Adsorption von niedermolekularen Plasmaproteinen sowie zur Aktivierung des hämostatischen Systems kommt. Hierdurch kommt es innerhalb von ein paar Sekunden zu der Bildung eines transienten Proteinfilms auf der Oberfläche („solid-liquid-interface“). Das Projekt fokussiert sich auf die Analyse und Konzentrationsbestimmung der adhärierten Plasmaproteine (u. a. Fibronektin, Fibrinogen, Albumin, Komplementfaktor C3, Vitronektin) sowie auf den Grad der Thrombozyten- und Blutgerinnungsaktivierung, um die komplexen Wechselwirkungen zwischen Blut und verschiedenen Biomaterialien zu verstehen.
Eine zentrale Frage ist hierbei, welche Rolle diese initialen Phänomene bei den nachfolgenden Wundheilungsprozessen und der Osseointegration spielen.
Diese Untersuchungen dienen ebenfalls der vergleichenden Beurteilung neuer Implantatmaterialien und neuartiger Oberflächenmodifikationen. Neben Nitinol, Titan- und Titan-basierten Beschichtungen werden aktuell auch bioresorbierbare Implantatmaterialien, bioaktive Beschichtungen sowie amorphe Silizium- und/oder Kohlenstoff-Basisschichten analysiert.
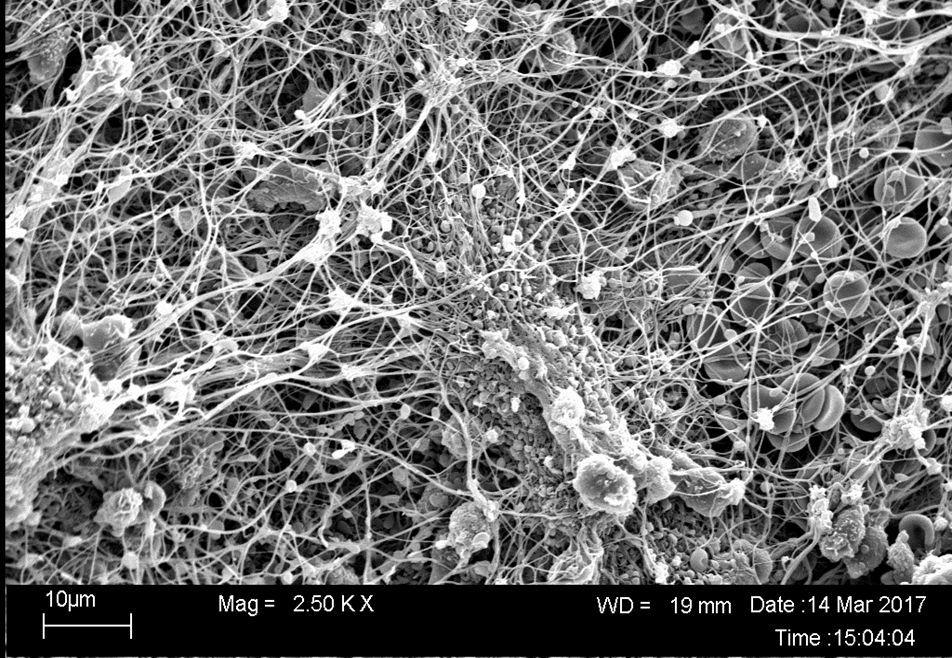
Entwicklung von In-vitro-Modellen und Validierung der immunmodulatorischen Eigenschaften von Implantaten
Durch die Fremdkörperexposition sowie die funktionalisierende und präkonditionierende Schicht aus Plasmaproteinen kommt es zur Aktivierung immunogener Prozesse, welche v. a. durch die Adhäsion verschiedener Plasmaproteine und deren Konzentrationserhöhung initiiert werden. Die Aktivierung des Komplementsystems, die Freisetzung von Zytokinen und Wachstumsfaktoren sowie spezielle Makrophagen sind maßgeblich an der Induktion der Osteoblastendifferenzierung beteiligt. Dieser Forschungsschwerpunkt zielt deshalb auf die Etablierung von humanbasierten Kokultur-Modellen ab, um die immunmodulatorischen Effekte verschiedener Biomaterialien zu untersuchen und um das komplexe Zusammenspiel von Implantatoberflächen und fremdkörperassoziierten Immunreaktionen valide untersuchen zu können.
Weiterhin sollen immunologische Reaktionen bei verschiedenen klinischen Behandlungsmethoden untersucht werden.
Bioaktive Implantatoberflächen
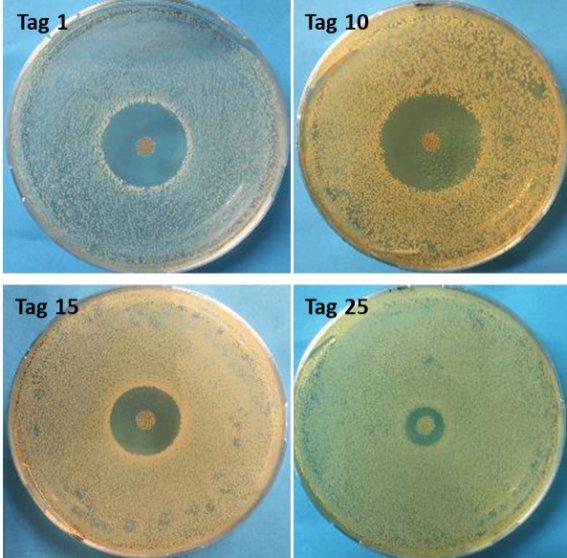
Ziel dieses Forschungsschwerpunktes ist es neuartige und effektive Implantatbeschichtungen zu entwickeln und zu untersuchen. So sollen u.a. durch die Induktion von spezifischen wundheilungsfördernden Wachstumsfaktoren physiologisch ablaufende Prozesse verstärkt und somit eine schnellere Wundheilung und eine damit einhergehende Reduktion von implantatassoziierten Komplikationen, verursacht primär durch bakterielle Infektionen, erzielt werden.
Weiterhin ist daher ein wichtiger Ansatz die Identifizierung von antibakteriell-wirkenden Substanzen, die durch eine kontrollierte Freisetzung vom Implantat über mehrere Wochen hinweg effektiv vor Infektionen schützen. Die klinische Situation kann so für die Patienten erheblich verbessert werden.
Literatur
Literatur
-
Denzinger M, Held M, Daigeler A, Krajewski S, Link A. Complement activation at the interface of wound dressings and blood does not influence keratinocyte migration/proliferation in vitro. Wound Repair Regen. 2020 Apr 12.
-
Xu Z, Krajewski S, Weindl T, Loeffler R, Li P, Han X, Geis-Gerstorfer J, Wendel HP, Scheideler L, Rupp F. Application of totarol as natural antibacterial coating on dental implants for prevention of peri-implantitis. Mater Sci Eng C Mater Biol Appl. 2020 May;110:110701.
-
Link A, Cattaneo G, Brynda E, Riedel T, Kucerova J, Schlensak C, Wendel HP, Krajewski S, Michel T. Hemocompatibility Testing of Blood-Contacting Implants in a Flow Loop Model Mimicking Human Blood Flow. J Vis Exp. 2020 Mar 5;(157).
-
Mühl-Benninghaus R, Abboud R, Ding A, Krajewski S, Simgen A, Tomori T, Bomberg H, Yilmaz U, Brochhausen C, Reith W, Cattaneo G. Preclinical Evaluation of the Accero Stent: Flow Remodelling Effect on Aneurysm, Vessel Reaction and Side Branch Patency. Cardiovasc Intervent Radiol. 2019 Dec;42(12):1786-1794.
-
Cattaneo G, Bräuner C, Siekmeyer G, Ding A, Bauer S, Wohlschlögel M, Lang L, Hierlemann T, Akimov M, Schlensak C, Schüßler A, Wendel HP, Krajewski S. In vitro investigation of chemical properties and biocompatibility of neurovascular braided implants. J Mater Sci Mater Med. 2019 Jun 4;30(6):67.
-
Denzinger M, Held M, Scheffler H, Haag H, Nussler AK, Wendel HP, Schlensak C, Daigeler A, Krajewski S. Hemocompatibility of different burn wound dressings. Wound Repair Regen. 2019 Sep;27(5):470-476.
-
Michel T, Link A, Abraham MK, Schlensak C, Peter K, Wendel HP, Wang X, Krajewski S. Generation of Cationic Nanoliposomes for the Efficient Delivery of In Vitro Transcribed Messenger RNA. J Vis Exp. 2019 Feb 1;(144).
-
Denzinger M, Link A, Kurz J, Krauss S, Thoma R, Schlensak C, Wendel HP, Krajewski S. Keratinocyte Growth Factor Modified Messenger RNA Accelerating Cell Proliferation and Migration of Keratinocytes. Nucleic Acid Ther. 2018 Dec;28(6):335-347.
-
Reinbold J, Hierlemann T, Urich L, Uhde AK, Müller I, Weindl T, Vogel U, Schlensak C, Wendel HP, Krajewski S. Biodegradable rifampicin-releasing coating of surgical meshes for the prevention of bacterial infections. Drug Des Devel Ther. 2017 Sep 18;11:2753-2762.
-
Abraham MK, Peter K, Michel T, Wendel HP, Krajewski S, Wang X. Nanoliposomes for Safe and Efficient Therapeutic mRNA Delivery: A Step Toward Nanotheranostics in Inflammatory and Cardiovascular Diseases as well as Cancer. Nanotheranostics. 2017 Apr 5;1(2):154-165.
-
Reinbold J, Uhde AK, Müller I, Weindl T, Geis-Gerstorfer J, Schlensak C, Wendel HP, Krajewski S. Preventing Surgical Site Infections Using a Natural, Biodegradable, Antibacterial Coating on Surgical Sutures. Molecules. 2017 Sep 19;22(9). pii: E1570.
-
Michel T, Luft D, Abraham MK, Reinhardt S, Salinas Medina ML, Kurz J, Schaller M, Avci-Adali M, Schlensak C, Peter K, Wendel HP, Wang X, Krajewski S. Cationic Nanoliposomes Meet mRNA: Efficient Delivery of Modified mRNA Using Hemocompatible and Stable Vectors for Therapeutic Applications. Mol Ther Nucleic Acids. 2017 Sep 15;8:459-468.
-
Braune S, Sperling C, Maitz MF, Steinseifer U, Clauser J, Hiebl B, Krajewski S, Wendel HP, Jung F. Evaluation of platelet adhesion and activation on polymers: Round-robin study to assess inter-center variability. Colloids Surf B Biointerfaces. 2017 Oct 1;158:416-422.
-
Kaplan O, Hierlemann T, Krajewski S, Kurz J, Nevoralová M, Houska M, Riedel T, Riedelová Z, Zárubová J, Wendel HP, Brynda E. Low-thrombogenic fibrin-heparin coating promotes in vitro endothelialization. J Biomed Mater Res A. 2017 Nov;105(11):2995-3005.
-
Denzinger M, Hinkel H, Kurz J, Hierlemann T, Schlensak C, Wendel HP, Krajewski S. Hemostyptic property of chitosan: Opportunities and pitfalls. Biomed Mater Eng. 2016 Sep 28;27(4):353-364.
-
Reinbold J, Hierlemann T, Hinkel H, Müller I, Maier ME, Weindl T, Schlensak C, Wendel HP, Krajewski S. Development and in vitro characterization of poly(lactide-co-glycolide) microspheres loaded with an antibacterial natural drug for the treatment of long-term bacterial infections. Drug Des Devel Ther. 2016 Sep 7;10:2823-2832. eCollection 2016.
-
Stang K, Krajewski S, Neumann B, Kurz J, Post M, Stoppelkamp S, Fennrich S, Avci-Adali M, Armbruster D, Schlensak C, Burgener IA, Wendel HP, Walker T. Hemocompatibility testing according to ISO 10993-4: discrimination between pyrogen- and device-induced hemostatic activation. Mater Sci Eng C Mater Biol Appl. 2014 Sep;42:422-8.
-
Krajewski S, Rheinlaender J, Ries P, Canjuga D, Mack C, Scheideler L, Schäffer TE, Geis-Gerstorfer J, Wendel HP, Rupp F. Bacterial interactions with proteins and cells relevant to the development of life-threatening endocarditis studied by use of a quartz-crystal microbalance. Anal Bioanal Chem. 2014 May;406(14):3395-406.
Zertifikate und Verbände

Focus: Top Nationales Krankenhaus 2025

Stern: Deutschlands Ausgezeichnete Arbeitgeber Pflege 24/25

Qualitätspartnerschaft mit der PKV

Erfolgsfaktor Familie

Die Altersvorsorge für den Öffentlichen Dienst





