Arbeitsgruppe Gentherapie für Schwerhörigkeit und Gehörlosigkeit
Die AG Reisinger befasst sich derzeit mit der Weiterentwicklung einer Gentherapie für Taubheit, die durch Mutationen im Gen OTOF bedingt ist. Bei weiteren grundlagenwissenschaftlichen Projekten schaffen wir die Voraussetzungen für die Entwicklung von weiteren Gentherapien. Unser Ziel ist es die Funktion des Innenohrs besser zu verstehen, neue Taubheitsgene zu charakterisieren, und mit neu entwickelten Gentherapien möglichst vielen Betroffenen eine kausale und wenig invasive Behandlungsmöglichkeit anbieten zu können.
Leitung
Leitung

Prof. Dr. rer. nat. Ellen Reisinger
Telefonnummer: 07071-29-88184
E-Mail-Adresse: ellen.reisinger@uni-tuebingen.de

Kontakt
frontend.sr-only_#{element.icon}:
Arbeitsgruppe Gentherapie für Schwerhörigkeit und Gehörlosigkeit
Universitätsklinik für Hals-Nasen-Ohrenheilkunde
Elfriede-Aulhorn-Str. 5
72076 Tübingen
frontend.sr-only_#{element.icon}:
André Deutschmann
Dr. rer. nat. Cell Biology
Mehr zur Person
frontend.sr-only_#{element.icon}:
Franziska Becker
M. Sc. Biochemistry
Mehr zur Person
frontend.sr-only_#{element.icon}:
Xanthoula Smyrnakou-Biedenbänder
M. Sc. Molecular Biotechnology
frontend.sr-only_#{element.icon}:
Ramil Arora
M. Sc.
Forschungsschwerpunkte
- Entwicklung von Gentherapien zur Wiederherstellung des Gehörs mit Adeno-assoziierten Viren
- Grundlagenforschung zum Verständnis der Ursachen von Taubheit und fortschreitender Schwerhörigkeit
- Regulation von Otoferlin durch Kinasen und deren Auswirkungen auf die synaptische Übertragung von Inneren Haarzellen
Expertise
- Transduktion von Zellen des Innenohrs mit Adeno-assoziierten Viren
- Molekularbiologie (Klonierungen, Real-Time PCR, Einzelzell-PCR)
- Entwicklung von Dual-AAV-Vektoren für lange cDNA Sequenzen
- Zellphysiologie der Inneren Haarzellen (= Sinneszellen des Innenohrs)
- Mausgenetik (Knock-out, Knock-In, CRISPR/Cas9-Mausmodelle)
- Untersuchung der synaptischen Funktion von Haarzellen
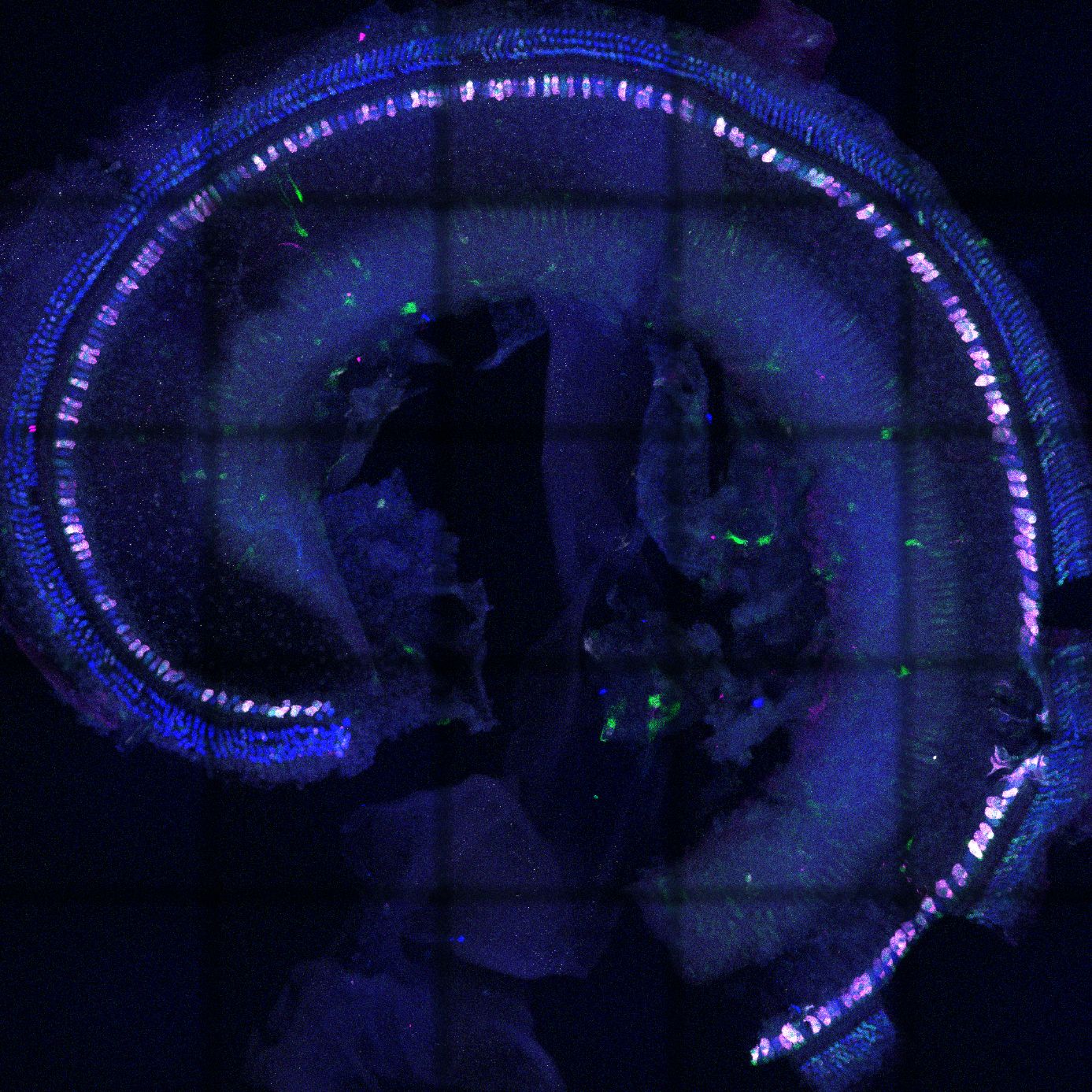
- Immunhistochemie, konfokale Fluoreszenzmikroskopie

Forschungsinteresse
In Deutschland kommen ca. 0,1 % der Bevölkerung, also etwa 83.000 Menschen, gehörlos auf die Welt (Deutscher Gehörlosen-Bund e.V.). Bezieht man diejenigen mit Schwerhörigkeit mit ein, zu welchen auch Altersschwerhörige zählen, sind sogar etwa 15 Millionen Deutsche betroffen (Hoerex).
Probleme mit dem Gehör können angeboren oder erworben sein. Viele verschiedene vererbbare Formen von Taubheit sind bekannt, also jene, die über Gene weitergegeben werden. Gene sind letztlich die Baupläne für Proteine. Wenn ein Protein im Ohr für den Hörvorgang benötigt wird, führt die Mutation dieses Gens zu Schwerhörigkeit oder Taubheit. Inzwischen sind etwa 150 solcher „Taubheitsgene“ bekannt. Es wird vermutet, dass weitere solcher Gene in den nächsten Jahren identifiziert werden – hier erweitert die Genomsequenzierung unsere Möglichkeiten enorm.
Vielen Betroffenen mit leichten bis mittleren Hörproblemen kann mit einem Hörgerät geholfen werden. Bei hochgradiger Schwerhörigkeit oder Taubheit kann Betroffenen ein Cochlea-Implantat eingesetzt werden. Die meisten Menschen können mit diesem Gerät Sprache gut verstehen. Taub geborenen Kindern ist es damit möglich, Lautsprache zu erlernen und am normalen Schulunterricht teilzunehmen. Bei bestimmten Formen der Taubheit funktioniert das Cochlea-Implantat jedoch nicht gut genug, dass die Betroffenen Sprache verstehen würden. Verschiedene Arbeitsgruppen der HNO-Klinik arbeiten derzeit daran, die Ursachen davon besser zu verstehen.
In der AG Reisinger entwickeln wir Gentherapien für bestimmte Formen von Schwerhörigkeit und Taubheit. Eine solche Therapie würde Betroffenen die mehrstündige Cochlea-Implantat-Operation und das Tragen des Geräts ersparen. Zudem würden Betroffene Tonhöhen besser unterscheiden können und damit z.B. besser Musik hören und Emotionen in Sprache erkennen können als mit Cochlea-Implantat. Allerdings kommt diese Gentherapie nur dann in Frage, wenn bei der Geburt noch alle Zellen und Zelltypen im Innenohr vorhanden sind. Dies ist nur bei wenigen Formen der Taubheit der Fall, da viele Taubheitsgene bereits während der embryonalen Entwicklung des Innenohrs eine wichtige Rolle spielen.
Die AG Reisinger befasst sich derzeit mit der Weiterentwicklung einer Gentherapie für Taubheit, die durch Mutationen im Gen OTOF bedingt ist. Das Gen OTOF kodiert für das knapp 2000 Aminosäuren lange Protein Otoferlin, das hauptsächlich in den Inneren Haarzellen des Innenohrs exprimiert wird. Da OTOF-Mutationen rezessiv vererbt werden, müssen beide Allele des Gens von einer Mutation betroffen sein, damit die Hörfunktion beeinträchtigt ist. Mit wenigen Ausnahmen führen die Mutationen in OTOF zu angeborener Taubheit, jedoch sind auch Mutationen, die einen progressiven Verlauf der Schwerhörigkeit aufweisen, bekannt. Bei manchen Mutationen, z.B. p.Ile515Thr, können Betroffene zwar Geräusche und Töne wahrnehmen, trotzdem können sie Sprache nur schlecht verstehen. Besonders bei Hintergrundgeräuschen ist das Gehör bei diesen Betroffenen nicht mehr in der Lage, die akustischen Informationen weiterzugeben, die für das Sprachverständnis notwendig wären (Strenzke et al., 2016). Da die Signalübertragung von der Hörsinneszelle auf die Nervenzelle hier viel zu schnell ermüdet, stellen Hörgeräte für Betroffene keine Hilfe dar. Bei manchen dieser Mutationen tritt eine weitere Besonderheit auf: während bei normaler Körpertemperatur die Betroffenen fast normale Hörschwellen aufweisen, sind sie bei einer erhöhten Körpertemperatur (ab 38,1°C) taub (Varga et al., 2006).
Die Gentherapie ist eine ursächliche Therapie, bei der die fehlende genetische Information eines Proteins gezielt in die Zellen geschleust wird, in denen sie benötigt wird. In der Zelle wandert die DNA in den Zellkern, wo sie stabil über Jahre hinweg verbleibt und so für die korrekte Herstellung des Proteins sorgt.
In einer Machbarkeitsstudie konnten wir zeigen, dass es möglich ist, mit Hilfe von zwei Adeno-assoziierten Viren die kodierende Sequenz für das Protein Otoferlin in die Inneren Haarzellen von hörgeschädigten Mäusen zu transportieren (Al-Moyed et al., 2019). Dadurch konnte Otoferlin in den Zellen exprimiert werden und das Hörvermögen teilweise wiederhergestellt werden. Durch den Vergleich mit unseren grundlagenwissenschaftlichen Studien wissen wir, dass wir die Proteinmengen weiter erhöhen müssen, um das Hören soweit zu verbessern, dass es möglichst nahe an das von normalhörenden Mäusen herankommt. Weiterhin beobachten wir, wie lange das Hörvermögen bei den so therapierten Mäusen bestehen bleibt. Unsere Experimente tragen mit dazu bei, dass klinische Versuche für eine Gentherapie mit Otoferlin in den nächsten Jahren starten können.

Bei weiteren grundlagenwissenschaftlichen Projekten schaffen wir die Voraussetzungen für die Entwicklung von weiteren Gentherapien. Unser Ziel ist es die Funktion des Innenohrs besser zu verstehen, neue Taubheitsgene zu charakterisieren, und mit neu entwickelten Gentherapien möglichst vielen Betroffenen eine kausale und wenig invasive Behandlungsmöglichkeit anbieten zu können.
Lehre
Lehrveranstaltungen mit Beteiligung der AG Reisinger
- Graduate Training Center for Neurosciences – Journal Club
- Graduate Training Center for Neurosciences - Sensory Systems II
Zertifikate und Verbände

Focus: Top Nationales Krankenhaus 2025

Stern: Deutschlands Ausgezeichnete Arbeitgeber Pflege 24/25

Qualitätspartnerschaft mit der PKV

Erfolgsfaktor Familie

Die Altersvorsorge für den Öffentlichen Dienst





